Les propriétés électroniques et stériques des carbènes N-hétérocycliques ont été exploitées pour la catalyse d’allylation d’aldéhyde par le biais de complexe organométalliques à base de PdII. Deux complexes ont été synthétisés à partir d’un ligand consistant d’un groupe NHC central portant un groupement phénoxy d’un côté et un bras de phosphonium de l’autre. Les complexes orthométallés et en pince ont été testé en catalyse avec des dérivés de benzaldéhyde ayant différents groupements en position para. L’effet du substituant para ainsi que la réactivité relative des deux complexes ont permis de proposer un mécanisme de catalyse.
Introduction
Dans de précédentes recherches, le Dr. Canac et ses collaborateurs ont synthétisé des ligands de type bis(NHC), bis(ylure de phosphonium) pouvant stabiliser un centre métallique par effet chélate. Ces ligands carbonés très riches en électrons étant moins susceptibles de se dissocier du métal que les ligands phosphines traditionnels (PR3),[1]Canac, Y., et al., A convenient access to N-phosphonio-substituted NHC metal complexes [M = Ag(I), Rh(I), Pd(II)]. Vol. 46. 2017.[2]Barthes, C., et al., A Palladium(II) Complex of a C4 Chelating Bis(NHC) Diphosphonium Bis(ylide) Ligand. Organometallics, 2018. 37(5): p. 673-678. il était intéressant d’étudier leur comportement en catalyse homogène. L’objectif était de synthétiser de nouveaux ligands de type NHC-ylure de phosphonium et de préparer leurs complexes de Pd(II) afin de les utiliser en catalyse. L’intérêt de travailler sur ce type de complexe à ligand entièrement carboné provient tout d’abord des propriétés stériques et électroniques uniques des carbènes N-hétérocycliques (NHC). Premièrement, comparativement aux ligands phosphines dont l’encombrement stérique s’oriente vers l’extérieur de la sphère de coordination, les substituants de part et d’autre du NHC forment une enveloppe vers l’intérieur de la sphère de coordination. Ainsi, la nature de ces substituants influence davantage la contrainte stérique sur la sphère de coordination du métal. Secondement, d’un point de vue électronique, les NHCs tout comme les ylures de phosphonium sont des ligands carbonés fortement σ donneurs. Les NHCs qui sont des carbènes singulets possèdent une orbitale σ dans le plan de l’hétéroatome, occupée par deux électrons, et une orbitale π vacante perpendiculaire à ce plan. L’interaction entre les orbitales π des hétéroatomes et l’orbitale π vacant du carbène diminue la rétro-donation du métal.[3]Silvia Diez-Gonzalez, S.N., Stereoelectronic parameters associated with N-heterocyclic carbene (NHC) ligands: A quest for understanding. ELSEVIER, 2007. 251(5-6): p. 874-883.
Méthode
1-(2-hydroxyphényl)-3-(3(triphénylphosphonio)propyl)-1H-imidazol-3-ium «préligand NHC-phénoxy-phosphonium» [1] : Sous atmosphère inerte, une solution composée de 500 mg (3,12 mmol) de 2-(1H-imidazol-1-yl)phénol et de 960 mg (2,08 mmol) de bromure de 3-bromopropyl-triphénylphosphonium dans 35 mL de chlorobenzène est chauffée à 120oC pendant 16h. Le solvant est évaporé sous vide. 2,44 g (14,22 mmol) de triflate de sodium et 35 mL de dichlorométhane sont ensuite ajoutés. Le mélange est agité à température ambiante pendant 16h. La solution est filtrée et le solvant est évaporé à sec. Le produit est lavé à l’eau et extrait au dichlorométhane. La phase organique est séchée sur Na2SO4 et le solvant est évaporé. Le produit est lavé à l’éther pour donner une poudre beige avec un rendement de 90%. RMN 1H (300 MHz, DMSO) : δ 10,89 ppm (s, 1H); δ 9,57 ppm (s, 1H); δ 8,10 ppm (t, 1H, J = 3 Hz); δ 7,90-7,96 ppm (m, 4H); δ 7,76-7,84 ppm (m, 12H); δ 7,52 ppm (dd, 1H, J = 9 Hz, J = 3 Hz); δ 7,43 (td, 1H, J = 6 Hz, J = 3 Hz); δ 7,16 ppm (dd, 1H, J = 6 Hz, J = 3 Hz); δ 7,05 (td, 1H, J = 6 Hz, J = 3 Hz). RMN 31P (300 MHz, DMSO) : δ 24,00 ppm.
Complexe de palladium (II) orthométallé NHC-phénolate-ylure « [Pd]orthophénolate » [2] : Dans un Schlenk sous azote, 200 mg (0,26 mmol) de pré-ligand NHC-phénoxy- phosphonium 1 est mélangé à 46 mg (0,26 mmol) de précurseur PdCl2 et 854 mg (2,62 mmol) de carbonate de césium dans 40 mL d’acétonitrile et est chauffé à 90oC pendant 16h. Le solvant est évaporé à sec. Le produit est dissous dans un minimum de dichlorométhane et précipité dans l’éther éthylique. Une poudre blanche est obtenue en rendement quantitatif. RMN 31P (400 MHz, CD3CN) : δ 33,25 ppm.
Complexe de palladium (II) bidenté NHC-phénolate-phosphonium « [Pd]pincephénolate » [3] : Dans un schlenk sous azote, 300 mg (0,39 mmol) de pré-ligand NHC-phénoxy- phosphonium 1 est mélangé à 70 mg (0,39 mmol) de précurseur PdCl2 et 435 mg (3,15 mmol) de carbonate de potassium dans 60 mL d’acétonitrile. La pyridine (96 μL, 1,17 mmol) est ensuite ajoutée et la solution est agitée à température ambiante pendant 2 jours. La solution est filtrée sur célite et le solvant est évaporé à sec. Le produit est dissous dans un minimum de dichlorométhane et précipité dans l’éther éthylique. Le produit est récupéré sous forme d’une poudre jaune dans un rendement quantitatif. RMN 1H (300 MHz, DMSO) : δ 8,89 ppm (s, 2H); δ 8,01 ppm (t, 1H, J = 6 Hz); δ 7,82 ppm (t, 3H, J = 6 Hz); δ 7,71-7,79 ppm (m, 6H); δ 7,61-7,71 ppm (m, 7H); δ 7,57 ppm (t, 2H, J = 6 Hz); δ 7,44 ppm (d, 1H, J = 6 Hz); δ 7,12 ppm (t, 1H, J = 6 Hz); δ 7,03 ppm (d, 1H, J = 6 Hz); δ 6,78 ppm (t, 1H, J = 6 Hz); δ 4,80 ppm (t, 2H, J = 6 Hz); δ 3,53 ppm (t, 2H, J = 12 Hz); δ 2,59 ppm (dt, 2H, J = 12 Hz, J = 6 Hz). RMN 31P (300 MHz, DMSO) : δ 23,57 ppm.
Procédure générale pour la catalyse d’allylation d’aldéhydes [4a-d]: Dans un schlenk sous atmosphère d’azote, 0,15 mmol d’aldéhyde est mélangé à 7,45 μmol (5% de charge catalytique) de catalyseur ([Pd]orthophénolate 2 ou [Pd]pincephénolate 3) et 0,18 mmol de tert-butyle étain allyle dans 0,6 mL de DMF anhydre. La réaction est chauffée à 60oC pendant 18h. Après lavage à l’eau, le produit de catalyse est extrait avec de l’éther éthylique.
Résultats
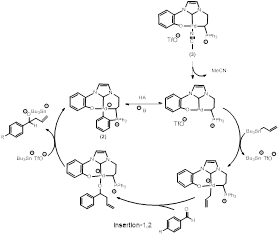
Dans le mécanisme proposé, le ligand labile se décoordinerait du centre métallique pour laisser place à une transmétallation entre le complexe de Pd et le tert-butyle étain allyle. Puis, une insertion 1,2 de l’aldéhyde électrophile entre le métal et l’allyle nucléophile aurait lieu en passant par un état de transition organisé où toutes les liaisons se brisent et se forment simultanément, ce qui expliquerait le besoin de chauffer la réaction. Finalement, le produit se décoordinerait du métal sous forme d’anion. L’excès de tert-butyle étain allyle formerait l’orthométallé, qui redeviendrait la pince en présence de l’acide carboxylique analogue à l’aldéhyde. L’anion serait reprotoné lors du traitement de la réaction en milieu aqueux.
Discussion
Deux conclusions peuvent être tirées des résultats présentés dans le Tableau 1 ci-dessus. La première est que plus le substituant en para de la fonction aldéhyde est électroattracteur, plus celui-ci réagit dans cette catalyse. En tenant compte du mécanisme proposé à la Figure 1, la plus forte conversion des aldéhydes plus électrophiles serait expliquée par leur complémentarité avec l’allyle nucléophile, d’où l’intérêt d’utiliser des catalyseurs organométalliques portant des ligands NHC et des ylures de phosphonium : la forte donation sigma du ligand NHC-ylure sur le centre métallique permettrait d’augmenter la densité électronique du Pd(II) et ainsi le caractère nucléophile de celui-ci.
La seconde conclusion pouvant être tirée de ces résultats est que le complexe [Pd]orthophénolate est moins actif en catalyse que le complexe [Pd]pincephénolate. Cette réactivité est due à la labilité des ligands. En effet, la liaison Pd-Cortho est très forte comparativement à celle entre le Pd et l’acétonitrile dans le cas de la pince. D’ailleurs, ce n’est pas l’orthométallé 2 qui est actif en catalyse, mais uniquement la pince 3. En effet, ces deux espèces sont en équilibre acido-basique et lors de la catalyse avec le [Pd]orthophénolate, des résidus d’acide carboxylique dans l’aldéhyde clivent la liaison Pd-Cortho et forment la pince qui elle est active en catalyse. À la fin de la réaction, un spectre RMN 31P a été effectué sur le milieu réactionnel de la catalyse pour les deux complexes. Dans les deux cas, un déplacement chimique de 34,45 ppm correspondant à l’orthométallé est observé. Ceci démontre encore une fois l’équilibre acido-basique entre les deux complexes. La basicité de l’allyle provoquerait la déprotonation du carbone Cortho et la formation du complexe orthométallé.
Conclusion
En premier lieu, il a pu être observé que le substituant sur l’aldéhyde affecte sa réactivité, du fait que plus celui-ci est électroattracteur, plus le carbonyle est électrophile et plus il réagit avec l’allyle nucléophile. Le caractère nucléophile de l’allyle provient de la densité électronique du Pd causée par ses ligands NHC et ylure fortement donneur σ. En second lieu, il a pu être observé que l’orthométallé est moins réactif que la pince. La réactivité de l’orthométallé ne provient d’ailleurs que de son équilibre acido-basique avec la pince. L’aldéhyde peut être contaminé de trace de l’acide carboxylique correspondant. Ce dernier est en mesure de cliver la liaison Pd-Cortho de l’orthométallé pour donner la pince. Le [Pd]orthophénolate serait un réservoir stable du [Pd]pincephénolate.
Inspiration
Cette recherche est inspirée de la publication suivante : Taakili, R., et al., NHC Core Phosphonium Ylide-based Palladium(II) Pincer Complexes: The Second Ylide Extremity Makes the Difference. Inorganic Chemistry, 2020. 59(10): p. 7082-7096
Références[+]
| ↑1 | Canac, Y., et al., A convenient access to N-phosphonio-substituted NHC metal complexes [M = Ag(I), Rh(I), Pd(II)]. Vol. 46. 2017. |
|---|---|
| ↑2 | Barthes, C., et al., A Palladium(II) Complex of a C4 Chelating Bis(NHC) Diphosphonium Bis(ylide) Ligand. Organometallics, 2018. 37(5): p. 673-678. |
| ↑3 | Silvia Diez-Gonzalez, S.N., Stereoelectronic parameters associated with N-heterocyclic carbene (NHC) ligands: A quest for understanding. ELSEVIER, 2007. 251(5-6): p. 874-883. |