Une étude d’un système photocatalytique à catalyseurs de cobaloximes-cyclohexyle est mené sous irradiation bleu. L’effet du ligand axial et de groupements rigides sur les propriétés photocatalytiques du système est évalué en fonctions des performances observées.
Introduction
La production d’hydrogène a initialement été inspirée de la photosynthèse. L’oxydation de l’eau permet la production de l’oxygène, alors que sa réduction génère de l’hydrogène. Ces deux réactions étant intimement reliés, l’idée de former un tel système en répliquant sa fonction, sans répliquer sa complexité, a surgi. Les premiers catalyseurs efficaces à base de cobaloxime (un dérivé de la vitamine B12) ont vu le jour dans les années 1980. Ce faisant, ils ont ouvert la voie à la production d’hydrogène à partir de l’énergie électrique (électrocatalyse). Avec le temps et les problèmes engendrés par les changements climatiques, l’hydrogène vert, produit à partir d’énergies entièrement renouvelables, a été développé. Les systèmes photocatalytiques, utilisant la lumière solaire comme source d’énergie, ont permis d’élever l’hydrogène en tant que carburant du futur, puisqu’il génère une quantité dérisoire de déchets. Quatre types de molécules sont nécessaires à ce système catalytique.
Tout d’abord,il faut un photosensibilisateur (PS), qui sert à récolter l’énergie solaire. Un bon photosensibilisateur absorbe la lumière dans la région du visible et de l’infrarouge, soit les principales émissions solaires reçues à la surface de la terre. Ensuite, il faut évidemment le catalyseur (HEC), qui a pour fonction de décupler l’efficacité de la réaction en agissant comme centre réactionnel. Pour terminer, il faut le donneur de proton et le donneur d’électron sacrificiel (SED) qui servent respectivement à fournir les protons requis à la génération d’hydrogène et à remplacer la demi-réaction générant l’oxygène, dans le système catalytique. L’objectif est de simplifier le système pour en étudier les réactions et propriétés, sans pour autant produire un système dans lequel il serait difficile de travailler. La figure 1 rapporte le processus général de la photosynthèse artificielle. L’état excité du PS est formé par incidence de l’énergie solaire. Celui-ci devient alors un meilleur oxydant et un meilleur réducteur, ce qui permet le transfert d’électron vers le catalyseur. La forme oxydée du PS est ensuite réduite par le donneur (S.E.D), afin de retourner à son état initial.
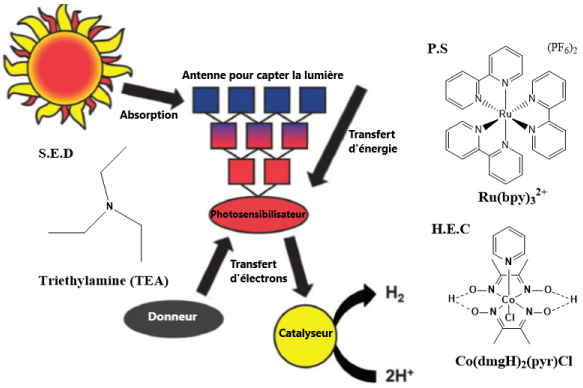
Figure 1 : Schéma général simplifié de la génération d’hydrogène par photocatalyse.[1]Frischmann, P. D.; Mahata, K.; Wurthner, F., Powering the future of molecular artificial photosynthesis with light-harvesting metallosupramolecular dye assemblies. Chem Soc Rev 2013, 42 (4), … Voir plus
Le défi actuel est synthétiser des catalyseurs à base de métaux abondants permettant une production d’hydrogène par photocatalyse comparable à celle des catalyseurs à base de métaux précieux, tel que le platine ou l’iridium.[2]Artero, V.; Chavarot-Kerlidou, M.; Fontecave, M., Splitting water with cobalt. Angew Chem Int Ed Engl 2011, 50 (32), 7238-66. L’avancée de cette recherche permettrait de supplanter la production d’hydrogène par reformage du méthane, de sorte à éliminer le dégagement de CO2 induit par cette méthode, qui est responsable d’environ 95% de l’hydrogène produit industriellement.[3]Han, B.; Wei, W.; Li, M.; Sun, K.; Hu, Y. H., A thermo-photo hybrid process for steam reforming of methane: highly efficient visible light photocatalysis. Chem Commun (Camb) 2019, 55 (54), … Voir plus L’hydrogène souffre encore de problèmes de stockage sécuritaire, qui sont en voie d’être réglé par la condensation de celui-ci sous forme solide, dans les hydrures métalliques.[4]Zhang, J.; Li, Z.; Wu, Y.; Guo, X.; Ye, J.; Yuan, B.; Wang, S.; Jiang, L., Recent advances on the thermal destabilization of Mg-based hydrogen storage materials. RSC Advances 2019, 9 (1), … Voir plus
Il est essentiel de comprendre les mécanismes de génération d’hydrogène, de même que de comprendre comment stabiliser les systèmes moléculaires obtenus, afin d’accroitre leur efficacité et leur durée de vie. C’est pourquoi l’ajout d’un groupement rigide, le cyclohexyle, a été tenté.

Figure 2: Représentation des catalyseurs analysé dans la présente étude.
On utilise généralement le TON (Turn Over Number) pour décrire la production totale d’hydrogène et le TOF (Turn Over Frequency), pour décrire la production d’hydrogène par heure. Le TON (nombre de mol de H2/nombre de mol de PS) est utile pour déterminer le meilleur catalyseur, mais a le défaut de ne pas tenir compte de la durée du système. Le TOF (nombre de mol de H2 / nombre de mol de PS / h) permet de comparer les catalyseurs entre eux, mais ne permet pas de déterminer la production totale d’hydrogène.
Génération d’hydrogène par photocatalyse
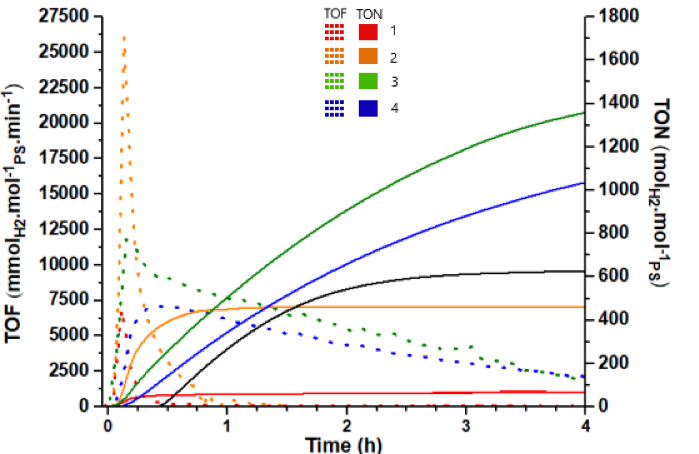
Figure 3 : TON et TOF de la production d’hydrogène pour le Ru(bpy)32+, associé avec les catalyseurs 1 à 4
Les expériences ont été menés dans le DMF, sous irradiation à 452nm (bleu), permettant l’obtention de l’état excité Ru(bpy)32+*, nécessaire à la génération d’hydrogène. Le S.E.D utilisé est la TEA (1M), alors que le HBF4 (0.1M) et l’eau (0.56M) sont les sources de protons. Les catalyseurs ont été analysés à une concentration de 0.5mM, associé avec le Ru(bpy)32+ 5µM.
Tous les systèmes sont dépourvus d’une période d’induction, pendant laquelle se déroule normalement l’excitation du PS et la réduction des espèces, démontrant que ces étapes se font très rapidement. Les catalyseurs 1 et 2 se dégradent rapidement (TOFmax de 6900 et 26000 mmolH2xmol-1PS), après avoir produit le maximum d’hydrogène dans les premières minutes (TON de 60 en 0.7h et de 460 en 1.5h). Au contraire, les catalyseurs 3 et 4 produisent plus lentement (TOFmax de 11800 et 7400 mmolH2xmol-1PS), mais ont une durée environ 4 fois supérieure (TON de 1500 et 1200 en 8h). Nos résultats sont en accord avec ceux de Yan et all, qui ont testé des catalyseurs et conditions semblables.[5]Liu, X.-F.; Zhang, Y.-X.; Yan, J., 4,4′-Bipyridine axially coordinated binuclear cobaloxime complexes as molecular catalysts for light-driven hydrogen evolution. Transition Metal Chemistry 2015, … Voir plus
Compte tenu que la seule différence entre les références et les catalyseurs testés est le cyclohexyle, on peut affirmer qu’il régule l’activité catalytique en réduisant la vitesse de dégradation du catalyseur ce qui réduit ainsi la vitesse de dégradation des autres espèces en solution.[6]Deponti, E.; Natali, M., Photocatalytic hydrogen evolution with ruthenium polypyridine sensitizers: unveiling the key factors to improve efficiencies. Dalton Trans 2016, 45 (22), 9136-47. Il semble également que l’ajout d’un groupement électrodonneur a un effet variable en fonction des conditions expérimentales utilisés.[7]Panagiotopoulos, A.; Ladomenou, K.; Sun, D.; Artero, V.; Coutsolelos, A. G., Photochemical hydrogen production and cobaloximes: the influence of the cobalt axial N-ligand on the system … Voir plus
Remerciements
Nous souhaitons remercier le CRSNG, ainsi que les FRQNT pour leur support financier.
Auteur de correspondance : Fax: +1 514 343 7586. Tel: +1 514 340 5156. Courriel: Garry.hanan@umontreal.ca
Références[+]
| ↑1 | Frischmann, P. D.; Mahata, K.; Wurthner, F., Powering the future of molecular artificial photosynthesis with light-harvesting metallosupramolecular dye assemblies. Chem Soc Rev 2013, 42 (4), 1847-70. |
|---|---|
| ↑2 | Artero, V.; Chavarot-Kerlidou, M.; Fontecave, M., Splitting water with cobalt. Angew Chem Int Ed Engl 2011, 50 (32), 7238-66. |
| ↑3 | Han, B.; Wei, W.; Li, M.; Sun, K.; Hu, Y. H., A thermo-photo hybrid process for steam reforming of methane: highly efficient visible light photocatalysis. Chem Commun (Camb) 2019, 55 (54), 7816-7819. |
| ↑4 | Zhang, J.; Li, Z.; Wu, Y.; Guo, X.; Ye, J.; Yuan, B.; Wang, S.; Jiang, L., Recent advances on the thermal destabilization of Mg-based hydrogen storage materials. RSC Advances 2019, 9 (1), 408-428. |
| ↑5 | Liu, X.-F.; Zhang, Y.-X.; Yan, J., 4,4′-Bipyridine axially coordinated binuclear cobaloxime complexes as molecular catalysts for light-driven hydrogen evolution. Transition Metal Chemistry 2015, 40 (3), 305-311. |
| ↑6 | Deponti, E.; Natali, M., Photocatalytic hydrogen evolution with ruthenium polypyridine sensitizers: unveiling the key factors to improve efficiencies. Dalton Trans 2016, 45 (22), 9136-47. |
| ↑7 | Panagiotopoulos, A.; Ladomenou, K.; Sun, D.; Artero, V.; Coutsolelos, A. G., Photochemical hydrogen production and cobaloximes: the influence of the cobalt axial N-ligand on the system stability. Dalton Trans 2016, 45 (15), 6732-8. |