La naissance prématurée est un problème de santé mondial coûteux et non résolu. Parmi les 15 millions de bébés par an naissant prématurément, 1,2 million meurent suite à des complications. La prématurité est également associée à des problèmes de santé à long terme, telle qu’une déficience visuelle due à une rétinopathie partiellement induite par les soins aux nouveau-nés. Présentement, les traitements contre une naissance prématurée peuvent seulement retarder le travail d’environ 24 à 48h. Toutefois, ils n’ont aucun effet sur les mécanismes qui précèdent l’induction du travail, notamment l’inflammation qui peut nuire au fœtus. La cytokine pro-inflammatoire interleukine-1β et son récepteur (IL-1R) ont des rôles clés dans la cascade de transduction de signaux menant à la naissance. Le modulateur peptidique de l’IL-1R 101.10 (1, H-D-Arg-D-Tyr-D-Thr-D-Val-D-Glu-D-Leu-D-Ala-NH2) a été conçu pour retarder la naissance, réduire l’inflammation prénatale et maintenir la vigilance immunitaire. En utilisant des analogues α-amino γ-lactame pour étudier les relations structure-activité du peptide prototypique 1, la compréhension des exigences topologiques pour l’activité et les mimétiques avec une capacité accrue à retarder la naissance et à améliorer la santé néonatale ont été découverts.
Introduction
Les naissances prématurées sont associées à des taux de morbidité et de mortalité élevés1. La prématurité, affectant 8 à 13% des femmes enceintes, est plus répandue dans les pays sous-développés, est coûteuse et cause des problèmes de santé à long terme[1]Chang, H. H.; Larson, J.; Blencowe, H.; Spong, C. Y.; Howson, C. P.; Cairns-Smith, S.; Lackritz, E. M.; Lee, S. K.; Mason, E.; Serazin, A. C.; Walani, S.; Simpson, J. L.; Lawn, J. E. Lancet 2013, 381 … Voir plus[2]Bourguet, C. B.; Claing, A.; Laporte, S. A.; Hebert, T. E.; Chemtob, S.; Lubell, W. D. Can. J. Chem. 2014, 92 (11), 1031-1040.. Notamment, les soins en incubateur peuvent provoquer une rétinopathie du prématuré avec des conséquences sérieuses sur la vision du nouveau-né.[3]Hellström, A.; Smith, L. E. H.; Dammann, O. Lancet (London, England) 1991, 337 (8733), 83-84. Les interventions thérapeutiques actuelles ne font que retarder la naissance, mais n’ont aucun effet sur l’inflammation qui peut éventuellement nuire au fœtus[4]Taguchi, A.; Yamashita, A.; Kawana, K.; Nagamatsu, T.; Furuya, H.; Inoue, E.; Osuga, Y.; Fujii, T. Reprod. Sci. 2017, 24 (1), 7-18..
Les infections bactériennes provoquent une réponse inflammatoire. Elles déclenchent entre 40 et 70% de toutes les naissances prématurées, et encore plus chez les prématurés de moins de 30 semaines d’âge post-conceptionnel. Une cascade de signalisation pro-inflammatoire qui conduit à une naissance prématurée est engendrée par la reconnaissance des molécules associées aux pathogènes (PAMPs) par les récepteurs Toll-like (TLRs).[5]Romero, R.; Brody, D. T.; Oyarzun, E.; Mazor, M.; Wu, Y. K.; Hobbins, J. C.; Durum, S. K. Am. J. Obstet. Gynecol. 1989, 160 (5), 1117-1123.
La cytokine pro-inflammatoire centrale, l’interleukine-1β (IL-1β), et son récepteur (IL-1R) jouent des rôles clé dans cette cascade. Ceux-ci causent des effets inflammatoires. Ils activent le complexe protéique du contrôle de la transcription du NF-κB afin de stimuler la vigilance immunitaire contre les agents pathogènes[6]Gerondakis, S.; Siebenlist, U. Cold Spring Harb. Perspect. Biol. 2010, 2 (5), a000182.. L’IL-1β est aussi impliquée dans la rétinopathie de la prématurité3. Les antagonistes anti-IL-1R actuellement approuvés par la FDA sont de grosses protéines qui ne sont pas utilisées pour retarder la naissance, en partie parce qu’elles inhibent toutes les actions exercées par l’IL-1β, y compris l’immunosuppression, ce qui augmenterait les risques d’infection[7]Opal, S. M.; Fisher, C. J.; Dhainaut, J.-F. A.; Vincent, J.-L.; Brase, R.; Lowry, S. F.; Sadoff, J. C.; Slotman, G. J.; Levy, H.; Balk, R. A.; Shelly, M. P.; Pribble, J. P.; LaBrecque, J. F.; … Voir plus[8]Roerink, M. E.; van der Schaaf, M. E.; Dinarello, C. A.; Knoop, H.; van der Meer, J. W. M. J. Neuroinflammation 2017, 14 (1), 16..
La collaboration entre les professeurs Chemtob (pharmacologie) et Lubell (chimie) a abouti à une approche peptidique unique pour inhiber l’IL-1R sans bloquer NF-κB, afin d’atténuer l’inflammation sans compromettre la vigilance immunitaire. En explorant des fragments peptidiques dérivés de son co-récepteur, le peptide 1 a été développé et s’est avéré être un antagoniste non toxique de l’IL-1R[9]Quiniou, C.; Sapieha, P.; Lahaie, I.; Hou, X.; Brault, S.; Beauchamp, M.; Leduc, M.; Rihakova, L.; Joyal, J.-S.; Nadeau, S.; Heveker, N.; Lubell, W.; Sennlaub, F.; Gobeil, F.; Miller, G.; … Voir plus. Le peptide 1 a démontré la capacité de retarder la naissance en inhibant l’inflammation utérine. En bloquant l’inflammation prénatale chez la mère et le fœtus, le peptide 1 a amélioré la santé du nouveau-né. Après la naissance, le peptide 1 a inhibé l’inflammation causée par l’hyperoxie dans le système vasculaire rétinien, freinant la rétinopathie induite par l’oxygène[10]Beaudry-Richard, A.; Nadeau-Vallée, M.; Prairie, É.; Maurice, N.; Heckel, É.; Nezhady, M.; Pundir, S.; Madaan, A.; Boudreault, A.; Hou, X. Sci. Rep. 2018, 8 (1), 1-13..
Discussion

Figure 1. Les résidus Agl et Hgl restreignent le squelette et la géométrie de la chaîne latérale du peptide 1 stabilisant un conformère de tour β
Dans le but de comprendre le conformère actif et d’améliorer l’efficacité du peptide 1, un programme a été lancé utilisant la chimie organique pour introduire des contraintes conformationnelles. Le résidu α-amino γ-lactame (Agl, lactame de Freidinger-Veber, Figure 1) utilise des contraintes covalentes pour restreindre la rotation autour des angles dièdres ω, ϕ et ψ dans le peptide[11]Geranurimi, A.; Lubell, W. D. Org. Lett. 2018, 20 (19), 6126-6129.. Les substituants β sur les résidus Agl peuvent imiter les groupes de chaînes latérales d’acides aminés avec un angle dièdre χ rigidifié11. Par exemple, les résidus β-hydroxyle Agl et Hgl peuvent servir d’analogues rigides de Ser et Thr[12]St-Cyr, D. J.; Jamieson, A. G.; Lubell, W. D. Org. Lett. 2010, 12 (8), 1652-1655.. En fonction de leur stéréochimie, les résidus Agl et Hgl peuvent induire une conformation de tour β dans les peptides, tels que 2 et 3[13]Freidinger, R.; Veber, D.; Perlow, D.; Brooks; Saperstein, R. Science 1980, 210 (4470), 656-658..
L’insertion des résidus Agl et Hgl dans le peptide 1 a été utilisée pour favoriser une géométrie optimale afin de bloquer sélectivement l’activité IL-1β sans immunosuppression[14]Geranurimi, A.; Cheng, C. W.; Quiniou, C.; Zhu, T.; Hou, X.; Rivera, J. C.; St-Cyr, D. J.; Beauregard, K.; Bernard-Gauthier, V.; Chemtob, S. Front. Chem. 2019, 7, 23.. Des procédés de synthèse pour insérer des résidus Agl et Hgl dans des peptides ont été respectivement conçus en utilisant le sulfamidate cyclique 4 et l’oxiranylglycine 5 comme bis-électrophile pour l’alkylation et l’acylation de l’amine N-terminale (Figure 2)11. En utilisant 4 et 5 dans la synthèse en phase solide, les peptides Agl et Hgl ont été préparés efficacement11.
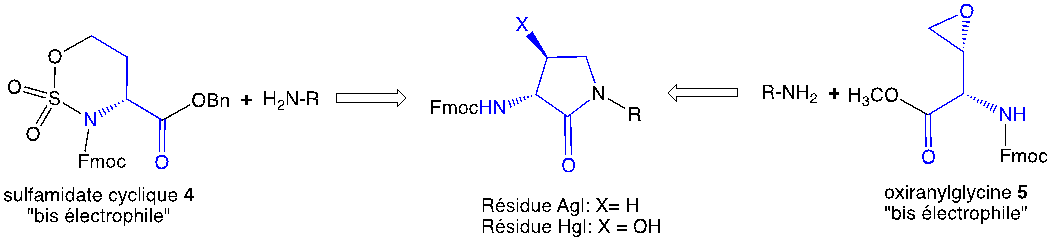
Figure 2. Construction de résidus Agl et Hgl sur une amine N-terminale en utilisant le sulfamidate cyclique 4 et l’oxiranylglycine 5.
Le remplacement systématique de chaque acide aminé dans le peptide 1 par un résidu Agl a fourni un ensemble d’analogues. Ceux-ci inhibaient typiquement la prolifération des thymocytes TF-1 qui est induite par IL-1β mieux que le peptide parent[15]Jamieson, A. G.; Boutard, N.; Beauregard, K.; Bodas, M. S.; Ong, H.; Quiniou, C.; Chemtob, S.; Lubell, W. D. J. Am. Chem. Soc. 2009, 131 (22), 7917-7927.. Bien que [(3R)-Agl3]-1 (2) ait réduit la prolifération des thymocytes TF-1, l’activité était inférieure à celle du peptide 1, probablement en raison de l’absence du groupe hydroxyle du résidu D-Thr3 de la chaîne latérale15.
Une comparaison de différents stéréoisomères de Agl et Hgl à la position 3 du peptide 1 a démontré ensuite que [(3R,4S)-Hgl3]-1 (3) présentait une activité identique à celle du peptide parent 114. Les deux ont efficacement inhibé la cascade inflammatoire induite par l’IL-1β, tel que démontré in vitro, en bloquant l’expression induite par IL-1β de gènes liés aux cytokines pro-inflammatoires: Il-1, IL-6 et cyclooxygénase 2 (COX-2)14. Ni le peptide 1, ni le 3 n’ont présenté d’activité inhibitrice de la signalisation NF-κB, mais les deux inhibaient la phosphorylation de trois kinases différentes: les kinases N-terminales c-Jun (JNK), les kinases associées à Rho 2 (ROCK2) et les kinases p38 activées par un mitogène (p38)14. De plus, les deux ont été efficaces pour retarder la naissance et contrer la vaso-oblitération des capillaires de la rétine dans les modèles de rongeurs nés prématurément et présentant une rétinopathie induite par l’oxygène respectivement14. Les fruits de ces recherches ont prouvé l’importance du stéréoisomère (3R,4S)-Hgl et du groupe hydroxyle pour l’activité. L’examen des spectres de dichroïsme circulaire des peptides 1 et 3 a révélé des formes de courbes qui étaient respectivement caractéristiques des conformations d’enroulement aléatoire et de tour β, indiquant l’importance de ce dernier conformère pour l’activité14.
Une série d’analogues Agl substitués en β du peptide 1 a ensuite été poursuivie sur la base de la connaissance de l’importance du substituant β et de la configuration du lactame pour l’activité du peptide 3[16]Geranurimi, A.; Cheng, C. W. H.; Quiniou, C.; Côté, F.; Hou, X.; Lahaie, I.; Boudreault, A.; Chemtob, S.; Lubell, W. D. Front. Chem. 2020, 8 (1182).. Des procédés de conversion de résidus Hgl en analogues d’Agl substitués en β ont été conçus sur la base de la chimie de Mitsunobu et de l’ouverture du sulfamidate cyclique (Figure 3)11. Par exemple, l’ouverture du sulfamidate cyclique 7 a donné l’azoture 9 qui, après incorporation dans un peptide, a été utilisé pour synthétiser un ensemble de onze analogues Agl substitués en β du peptide 1 par des voies comportant soit une réduction d’azoture et une acylation de l’amine correspondant, ou soit par des cycloadditions d’azoture-alcyne catalysées par le cuivre16.
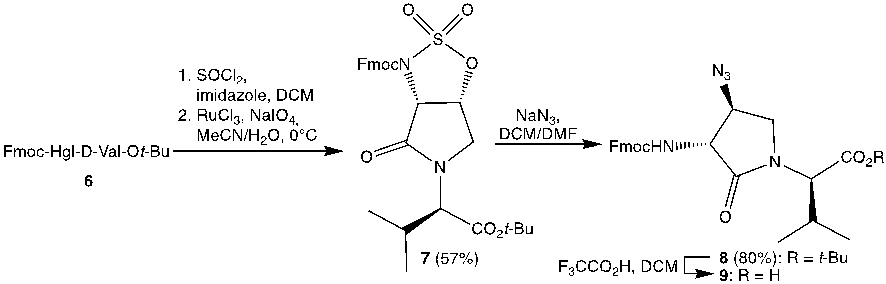
Figure 3. Synthèse du Fmoc-3R,4S-(4-N3)Agl-D-Val-OH (9).16
Parmi les analogues, le [3-(4-phényltriazolyl)Agl3]-1 (peptide 10) a présenté une activité supérieure au peptide 1 dans l’inhibition de la phosphorylation de la p38 kinase et de l’expression des gènes de cytokines induite par l’IL-1β. De plus, dans les modèles de rongeurs, le peptide 10 a retardé la naissance et inhibé la rétinopathie induite par l’oxygène respectivement avec une activité égale et supérieure à celle du peptide 116. Le spectre de dichroïsme circulaire du peptide 10 a montré une forme caractéristique d’un tour β indiquant sa pertinence pour l’activité. De plus, comme le peptide 1, le peptide 10 n’a eu aucun effet sur la signalisation de NF-κB qui est vital pour la vigilance immunitaire.
Conclusion et perspective
La contrainte lactame du peptide 1 a fourni un aperçu de la topologie requise pour bloquer la signalisation pro-inflammatoire induite par IL-1β sans perturbation de la vigilance immunitaire. Des mimétiques peptidiques bonifiés ont également été conçus pour retarder la naissance et améliorer la santé néonatale. Les prototypes et les informations acquises à partir de l’étude du peptide 1 à l’aide de la contrainte lactame guident la voie pour moduler sélectivement la signalisation de l’IL-1R pour le traitement des naissances prématurées afin d’améliorer la qualité de vie des nouveau-nés.
Références[+]
| ↑1 | Chang, H. H.; Larson, J.; Blencowe, H.; Spong, C. Y.; Howson, C. P.; Cairns-Smith, S.; Lackritz, E. M.; Lee, S. K.; Mason, E.; Serazin, A. C.; Walani, S.; Simpson, J. L.; Lawn, J. E. Lancet 2013, 381 (9862), 223-34. |
|---|---|
| ↑2 | Bourguet, C. B.; Claing, A.; Laporte, S. A.; Hebert, T. E.; Chemtob, S.; Lubell, W. D. Can. J. Chem. 2014, 92 (11), 1031-1040. |
| ↑3 | Hellström, A.; Smith, L. E. H.; Dammann, O. Lancet (London, England) 1991, 337 (8733), 83-84. |
| ↑4 | Taguchi, A.; Yamashita, A.; Kawana, K.; Nagamatsu, T.; Furuya, H.; Inoue, E.; Osuga, Y.; Fujii, T. Reprod. Sci. 2017, 24 (1), 7-18. |
| ↑5 | Romero, R.; Brody, D. T.; Oyarzun, E.; Mazor, M.; Wu, Y. K.; Hobbins, J. C.; Durum, S. K. Am. J. Obstet. Gynecol. 1989, 160 (5), 1117-1123. |
| ↑6 | Gerondakis, S.; Siebenlist, U. Cold Spring Harb. Perspect. Biol. 2010, 2 (5), a000182. |
| ↑7 | Opal, S. M.; Fisher, C. J.; Dhainaut, J.-F. A.; Vincent, J.-L.; Brase, R.; Lowry, S. F.; Sadoff, J. C.; Slotman, G. J.; Levy, H.; Balk, R. A.; Shelly, M. P.; Pribble, J. P.; LaBrecque, J. F.; Lookabaugh, J.; Donovan, H.; Dubin, H.; Baughman, R.; Norman, J.; DeMaria, E.; Matzel, K.; Abraham, E.; Seneff, M. Crit. Care Med. 1997, 25 (7), 1115-1124. |
| ↑8 | Roerink, M. E.; van der Schaaf, M. E.; Dinarello, C. A.; Knoop, H.; van der Meer, J. W. M. J. Neuroinflammation 2017, 14 (1), 16. |
| ↑9 | Quiniou, C.; Sapieha, P.; Lahaie, I.; Hou, X.; Brault, S.; Beauchamp, M.; Leduc, M.; Rihakova, L.; Joyal, J.-S.; Nadeau, S.; Heveker, N.; Lubell, W.; Sennlaub, F.; Gobeil, F.; Miller, G.; Pshezhetsky, A. V.; Chemtob, S. J. Immunol. 2008, 180 (10), 6977-6987. |
| ↑10 | Beaudry-Richard, A.; Nadeau-Vallée, M.; Prairie, É.; Maurice, N.; Heckel, É.; Nezhady, M.; Pundir, S.; Madaan, A.; Boudreault, A.; Hou, X. Sci. Rep. 2018, 8 (1), 1-13. |
| ↑11 | Geranurimi, A.; Lubell, W. D. Org. Lett. 2018, 20 (19), 6126-6129. |
| ↑12 | St-Cyr, D. J.; Jamieson, A. G.; Lubell, W. D. Org. Lett. 2010, 12 (8), 1652-1655. |
| ↑13 | Freidinger, R.; Veber, D.; Perlow, D.; Brooks; Saperstein, R. Science 1980, 210 (4470), 656-658. |
| ↑14 | Geranurimi, A.; Cheng, C. W.; Quiniou, C.; Zhu, T.; Hou, X.; Rivera, J. C.; St-Cyr, D. J.; Beauregard, K.; Bernard-Gauthier, V.; Chemtob, S. Front. Chem. 2019, 7, 23. |
| ↑15 | Jamieson, A. G.; Boutard, N.; Beauregard, K.; Bodas, M. S.; Ong, H.; Quiniou, C.; Chemtob, S.; Lubell, W. D. J. Am. Chem. Soc. 2009, 131 (22), 7917-7927. |
| ↑16 | Geranurimi, A.; Cheng, C. W. H.; Quiniou, C.; Côté, F.; Hou, X.; Lahaie, I.; Boudreault, A.; Chemtob, S.; Lubell, W. D. Front. Chem. 2020, 8 (1182). |