La chimie organométallique porte principalement sur l’étude des complexes impliquant les métaux de transition et leurs ligands. L’association de ceux-ci aux centres métalliques est fréquemment le résultat du remplissage partiel ou complet de leur couche de valence (règle des 18 électrons).[1]Amgoune, A.; Bourissou, D. Chem. Commun., 2011, 47, 859-871.
Pour ce faire, les métaux, déficients en électrons, se lient à ces molécules, alors appelées ligands, par l’acceptation ou le partage d’électrons. C’est pourquoi les ligands donneurs σ L et X sont bien connus en chimie organométallique ; selon le modèle covalent, la donation d’une paire d’électrons par le ligand L ou le partage d’un électron par le ligand X représentent des interactions par lesquelles le métal atteint une couche de valence remplie. Dans le premier cas, le métal agit comme un acide de Lewis. Cependant, la rétrodonation est observée lorsqu’un ligand accepteur π lié à un métal voit celui-ci peupler un orbitale π* du ligand avec ses propres électrons, soit un charactère semblable à une base de Lewis. Cette propriété rend envisageable l’idée qu’un complexe puisse impliquer une liaison au sein de laquelle le métal agit purement comme une base de Lewis. C’est le cas des interactions M→Z. En effet, les ligands Z, accepteurs σ, agissent comme des acides de Lewis, acceptant une paire d’électrons du centre métallique. En ce sens, ils représentent l’inverse des ligands L (figure 1).

Figure 1 – Interactions métal-ligand.
La figure 2 présente un diagramme orbitalaire simplifié de l’interaction entre l’orbitale dz[2]Muir, K. W.; Ibers, J. A. Inorg. Chem., 1969, 8, 1921-1928.
d’un métal et l’orbitale p vide d’un ligand Z (pris de ref. 1).
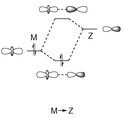
Figure 2 – Diagramme orbitalaire simplifiée de l’interaction M→Z.
Afin de démontrer qu’un complexe présente réellement une liaison M→Z, il est nécessaire de déterminer la distance entre les deux noyaux. Pour se faire, l’analyse par diffraction de rayons X est utilisée. La distance devrait être inférieure à la somme des rayons de van der Waals et similaire à la somme des rayons covalents. L’utilisation de la spectroscopie RMN est particulièrement appropriée lorsque le ligand Z est actif.
La première caractérisation d’une liaison de type M→Z répertoriée dans la littérature date de 1969 (figure 3).[3]Burlitch, J. M.; Leonowicz, M. E.; Petersen, R. B.; Hughes, R. E. Inorg. Chem., 1979, 14, 1097-1105. Un second exemple suit en 1979, mais le sujet n’est pas vraiment développé pour les 20 années suivantes.3 Ces 2 complexes constituent des exemples de liaison M→Z non supportée. La figure 4 présente des liaisons M→Z supportées par des contreforts ou buttresses.[4]Hill, A. F.; Owen, G. R.; White, A. J. P.; Williams, D. J. Angew. Chem., Int. Ed., 1999, 38, 2759-2761.[5]Bontemps, S.; Gornitzka, H.; Bouhadir, G.; Miqueu, K.; Bourissou, D. Angew. Chem., Int. Ed., 2006, 45, 1611-1614. En d’autres termes la liaison M→Z provient d’un ligand chélatant réalisant aussi des liaisons M←L avec le métal. Ces dernières augmentent la densité électronique et le caractère basique de l’atome métallique et, par le fait même, solidifient sa liaison avec l’accepteur σ.

Figure 3 – Premiers exemples de complexes impliquant des liaisons M→Z dans la littérature.
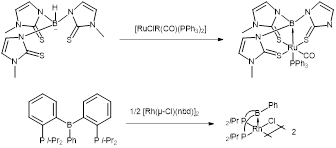
Figure 4 – Formation de complexes avec des interactions M→Z supportées.
Les candidats pouvant réaliser une liaison M→Z sont SO2, les éléments du groupe 13 (B, Al, Ga, In) et certains éléments plus lourds du groupe 14 (Si, Sn). Ces derniers reçoivent des électrons du métal dans une orbitale basse σ* et deviennent hypervalents. Ils sont particulièrement intéressant d’un point de vu analytique, car ils permettent l’utilisation de la RMN29Si et de la RMN119Sn.
Peu est connu sur la réactivité des complexes impliquant la liaison M→Z, mais beaucoup de développement a été fait dans les 20 dernières années. Bourissou et al. ont démontré la possibilité d’employer ces complexes dans des réactions d’hydro-déchlorination (figure 5).[6]Kameo, H.; Yamamoto, J.; Asada, A.; Nakazawa, H.; Matsuzaka, H.; Bourissou, D. Angew. Chem., Int. Ed., 2019, 58, 18783-18787.
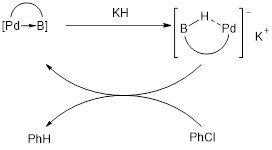
Figure 5 – Hydro-déchlorination reportée par Bourissou et al.
Plus récemment, Bourissou a aussi réalisé un couplage catalytique de sila-Negishi permettant de transformer de manière élégante un fluorosilane en organosilane par l’exploitation des interactions M→Si et Si→F (Figure 6).[7]Kameo, H.; Yamamoto, H.; Ikeda, K.; Isasa, T.; Sakaki, S.; Matsuzaka, H.; Garcia-Rodeja, Y.; Miqueu, K.; Bourissou, D. J. Am. Chem. Soc., 2020, 142, 14039-14044.
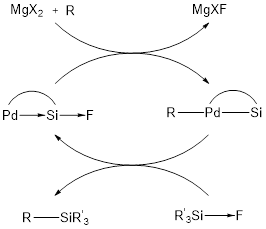
Figure 6 – Cycle catalytique de sila-Negishi reporté par Bourissou et al.
Autrement, Peters et al. ont réalisé une hydrogénation réversible à l’aide d’un catalyseur nickel-bore (figure 7) ainsi qu’une réduction de N2 en NH3 grâce à un catalyseur fer-bore (figure 8).[8]Harman, W. H.; Peters, J. C. J. Am. Chem. Soc., 2012, 134, 5080-5082.[9]Chalkley, M. J.; Del Castillo, T. J.; Matson, B. D.; Roddy, J. P.; Peters, J. C. ACS Cent. Sci. 2017, 3, 217-223. Ce dernier exemple est probablement le plus intéressant d’un point de vue pratique, car il concerne la production d’ammoniac, soit un enjeu grandement important à l’échelle planétaire. Toutefois le rôle de la liaison M→Z demeure nébuleux.

Figure 7 – Hydrogénation réversible reportée par Harman & Peters.
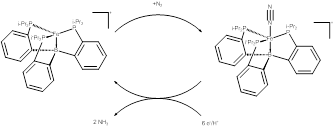
Figure 8 – Synthèse d’ammoniac reportée par Peters et al.
Conclusion
En 20 ans, le développement de la chimie des composés M→Z a permis la synthèse de nombreux nouveaux complexes aux propriétés particulières et intéressantes. L’un de ces complexes a permis d’établir un cycle catalytique de sila-Negishi pour la toute première fois alors qu’un autre représente l’un des meilleurs catalyseurs monoatomiques pour la synthèse de l’ammoniac, soit l’une des avenues les plus prometteuses comme alternative à la synthèse Haber-Bosch, processus responsable de 1.4% des dépenses énergétiques mondiales.[10]Yandulov, V. D.; Schrock, R. R. Science, 2003, 301, 76-78. Ces deux exemples démontrent l’immense potentiel que possède la chimie ici traitée.
Références[+]
| ↑1 | Amgoune, A.; Bourissou, D. Chem. Commun., 2011, 47, 859-871. |
|---|---|
| ↑2 | Muir, K. W.; Ibers, J. A. Inorg. Chem., 1969, 8, 1921-1928. |
| ↑3 | Burlitch, J. M.; Leonowicz, M. E.; Petersen, R. B.; Hughes, R. E. Inorg. Chem., 1979, 14, 1097-1105. |
| ↑4 | Hill, A. F.; Owen, G. R.; White, A. J. P.; Williams, D. J. Angew. Chem., Int. Ed., 1999, 38, 2759-2761. |
| ↑5 | Bontemps, S.; Gornitzka, H.; Bouhadir, G.; Miqueu, K.; Bourissou, D. Angew. Chem., Int. Ed., 2006, 45, 1611-1614. |
| ↑6 | Kameo, H.; Yamamoto, J.; Asada, A.; Nakazawa, H.; Matsuzaka, H.; Bourissou, D. Angew. Chem., Int. Ed., 2019, 58, 18783-18787. |
| ↑7 | Kameo, H.; Yamamoto, H.; Ikeda, K.; Isasa, T.; Sakaki, S.; Matsuzaka, H.; Garcia-Rodeja, Y.; Miqueu, K.; Bourissou, D. J. Am. Chem. Soc., 2020, 142, 14039-14044. |
| ↑8 | Harman, W. H.; Peters, J. C. J. Am. Chem. Soc., 2012, 134, 5080-5082. |
| ↑9 | Chalkley, M. J.; Del Castillo, T. J.; Matson, B. D.; Roddy, J. P.; Peters, J. C. ACS Cent. Sci. 2017, 3, 217-223. |
| ↑10 | Yandulov, V. D.; Schrock, R. R. Science, 2003, 301, 76-78. |